造血幹細胞とは
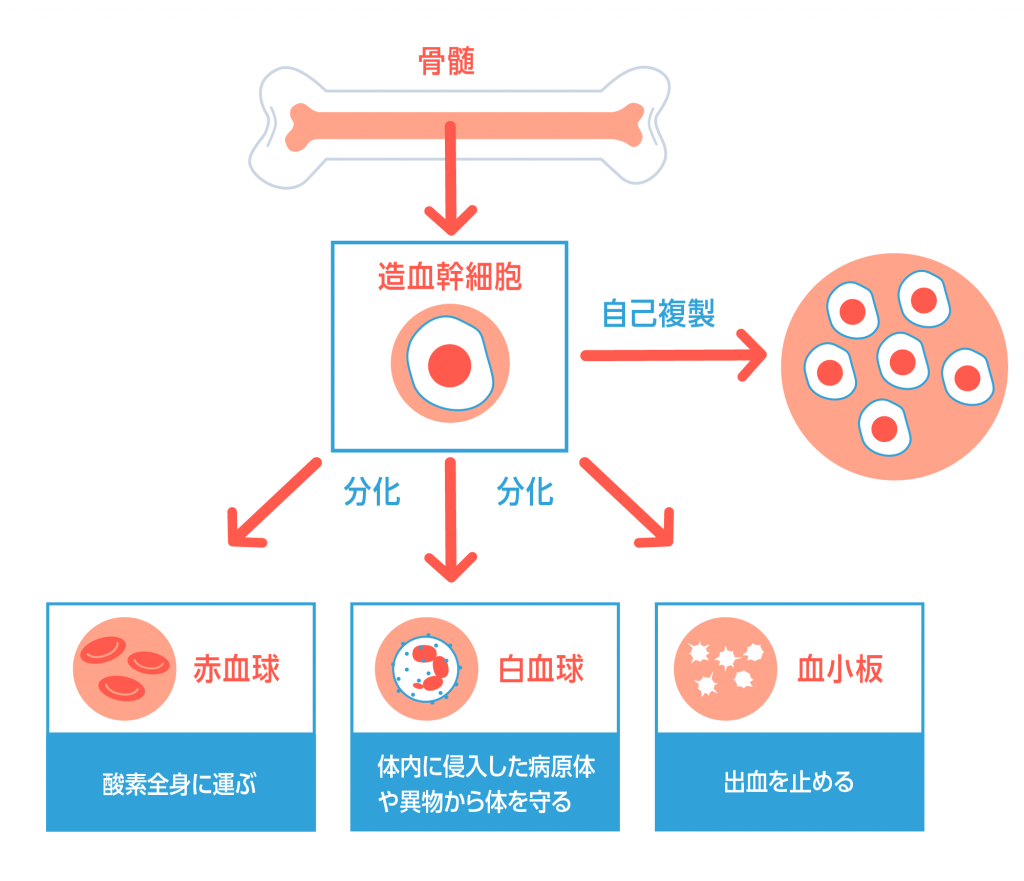
骨の中心部に固めのスポンジのような骨髄という部分があります。ここで血液が作られます(造血)。骨髄には造血幹細胞が住み着いていて、これが骨髄内で分化・成長し、血球になります。
造血幹細胞は全ての血球の源となる細胞です。細胞分裂により同じ細胞を複製することができます(自己複製)。また、赤血球などの様々な血球に分化することもできます(分化)。
造血幹細胞は、通常、骨髄の中に存在しますが、G-CSF(顆粒球コロニー刺激因子)を注射すると、全身を流れている血液(末梢血)にも移動してきます。また、母親と胎児を結んでいるへその緒の血液(さい帯血)にも豊富に含まれています。
造血幹細胞移植とは
造血幹細胞移植は、病的な骨髄を健康な骨髄に入れ替える治療法です。移植という言葉からは、外科手術のようなイメージをお持ちの方もいらっしゃるかもしれませんが、手術をするわけではありません。
患者さんの病的な骨髄を抗がん剤や放射線などで治療をした後に、造血幹細胞を移植(植える)わけですが、骨髄に直接植えなくても輸血や点滴と同じように血管内に注入すれば、しばらくすると骨髄に根付き、正常な血液が造られるようになります。
移植される造血幹細胞は、ドナーから提供された造血幹細胞(骨髄・末梢血・さい帯血)、あるいは、予め採取して凍結保存しておいた自分自身の造血幹細胞(自家末梢血)になります。
移植前には前処置として自身の造血幹細胞を全滅させる必要があるため、抗がん剤を大量に投与したり全身放射線照射を受けます。
造血器腫瘍に対して造血幹細胞移植を行う場合には、大量の抗がん剤や全身放射線照射を用いた移植前処置によって骨髄(造血)機能や免疫機能を十分に抑えてから移植を行います。
造血幹細胞移植の種類
造血幹細胞移植には「自家移植」と「同種移植」の2種類があります。これは、患者さんとドナーとの関係性で分類されるものです。
1.自家移植
抗がん剤に感受性を有する血液腫瘍が主な治療対象になります。患者自身の造血幹細胞をあらかじめ採取・凍結保存しておいて、大量化学療法後に起こる骨髄抑制を軽減する目的で、化学療法後に自分の造血幹細胞を戻す方法を自家移植といいます。自家移植の場合、自分の細胞なので移植後のGVHD(移植片対宿主病)が起きず、移植関連死(再発以外の移植合併症による死亡)が少ないのが特徴です。
2.同種移植
兄弟姉妹、骨髄バンク、さい帯血バンクなどのように他人の造血幹細胞を移植する場合を同種移植と呼びます。この場合、患者のHLAと適合した造血幹細胞が選ばれますが、あくまでも他人のものなので、厳密には完全に一致することはなく、移植後のGVHD(移植片対宿主病)は一定の率で起こります。、また、それに伴う合併症の頻度も高く、移植関連死も起きやすいとされています。
しかし、他人の造血幹細胞を使用するため、患者さんの骨髄に病気が残っていても、あるいは、骨髄に機能障害があっても受けられる治療法です。
移植後に免疫力によるGVL効果(移植片対白血病効果)が期待できることから、腫瘍に対する効果は同種移植のほうが強いと考えられています。
移植に使用する細胞(造血幹細胞ソース)
1.骨髄移植
骨髄液に含まれる造血幹細胞を移植する方法。通常、骨髄液の採取は全身麻酔下において腸骨という骨盤の骨から骨髄穿刺針を用いて採取されます。他の移植に比べて移植実績が多いことが利点です。しかし、欠点としては、全身麻酔やあらかじめ自己血貯留が必要であり、ドナーの負担が大きいことが挙げられます。
2.さい帯血移植
さい帯血の提供に同意した妊産婦がドナーとなり、分娩後にさい帯血を採取、さい帯血中に含まれる造血幹細胞を移植する方法です。
血液の病気などにより血液を正常に造れなくなった患者さんに、さい帯血を移植することによって、患者さんの血液を造る力を回復させることができます。
ドナーへの負担がなく、HLAが一部不一致でも移植が可能であり、すでに凍結・保存されているため、必要な時に提供・移植が可能であるというメリットがあります(骨髄バンクドナーからの移植の場合は提供までには4カ月弱かかる)。その他、慢性GVHDが起こりにくいともいわれています。
採取できる細胞数が限られているため、移植が可能な患者さんは小児や体重が軽い成人が中心でしたが、近年では、体重の重い成人にも移植ができるようになってきました。骨髄移植に比べると生着が遅く、生着不全が多いという欠点もあります。
3.末梢血幹細胞移植
全身をめぐっている血液(末梢血)中に存在する造血幹細胞を採取し、患者さんに移植する方法です。
通常、造血幹細胞は骨髄にあり、末梢血中にはほとんどありません。そこで、末梢血中の造血幹細胞を増やすためにG-CSF(顆粒球コロニー刺激因子)を投与し、骨髄から末梢血中に流れてきた造血幹細胞を、血球成分分離装置を使って採取します。
移植後の造血回復が早いことや採取の際にドナーの全身麻酔が不要であることなどが利点ですが、一方で、慢性GVHDの頻度が高いことや、ドナーに対してG-CSFの投与が必要であり、G-CSF投与による長期の安全性が不明であることなどが欠点として考えられます。
移植前処置の違いによる分類
1.フル移植
骨髄破壊的前処置後に造血幹細胞を移植する方法です。前処置として抗がん剤の大量投与や全身放射線照射によって、十分な骨髄破壊効果と免疫抑制効果を得た後に、造血幹細胞を移植します。一般的には50歳~55歳までの患者さんが適応になります。
2.ミニ移植
前処置の抗がん剤を減量し、移植された造血幹細胞が免疫反応によってがん細胞を攻撃するGVL効果(移植片対白血病効果)を期待する治療法がミニ移植です。実際には、骨髄・免疫抑制効果を有する骨髄非破壊的前処置後に造血幹細胞を移植する方法が多く用いられ、厳密なミニ移植は国内ではほとんど使われていません。
骨髄非破壊的前処置でも抗がん剤の投与量が減って、前処置の際の身体的負担が軽減されているため、高齢者に対する移植も可能です。フル移植に比べていろいろな臓器障害や粘膜障害が少なく、臓器障害を持った患者さんにも移植のチャンスが出てきました。
HLAとは
HLAとは、同種移植を可能にする白血球の相性を決めているもので、白血球の表面に存在するタンパク(ヒト白血球抗原)です。
ヒトが自己と非自己を認識するうえで最も重要な抗原で、拒絶やGVHDに関連しています。「白血球の血液型」とも言えますが、赤血球のABO式のように数種類で表されるものではなく、各遺伝子座には数十種類から数百種類の遺伝子が存在するため、HLA遺伝子の組み合わせは膨大になります。HLAが一致する確率は同胞(兄弟)で4分の1ですが、非血縁者間では500~10,000分の1以下になります。
通常、造血幹細胞移植の際に合わせるHLAとしてはA、B、DRという3座6抗原が知られていて、父由来のものと母由来のものの6種類を検査し、一致するドナーを探すところから始まります。
